AB2离子化合物的阴、阳离子的电子层结构相同,每摩尔AB2分子中含有54mol电子,根据下列反应:
① H2+ B2 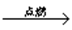 C ② B2 + X → Y + AB2 + H2O
C ② B2 + X → Y + AB2 + H2O
③ Y+C → AB2 + Z(Z有漂白作用)
(1)写出下列物质的化学式:AB2________,X_________,Y_________
(2)用电子式表示AB2的形成过程____________
(3)写出反应②的化学方程式____________
AB2离子化合物的阴、阳离子的电子层结构相同,每摩尔AB2分子中含有54mol电子,根据下列反应:
① H2+ B2 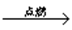 C ② B2 + X → Y + AB2 + H2O
C ② B2 + X → Y + AB2 + H2O
③ Y+C → AB2 + Z(Z有漂白作用)
(1)写出下列物质的化学式:AB2________,X_________,Y_________
(2)用电子式表示AB2的形成过程____________
(3)写出反应②的化学方程式____________