孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下: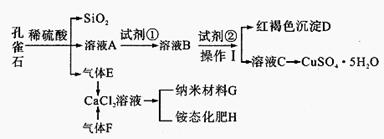
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
| 物质 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe(OH)3 |
2.2 |
3.2 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。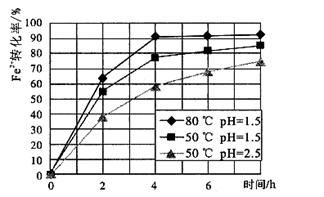
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00 mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
 H2O,该反应的化学方程式为 。
H2O,该反应的化学方程式为 。 。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):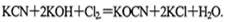 该反应中,被氧化的元素是___________,氧化产物是_______________。
该反应中,被氧化的元素是___________,氧化产物是_______________。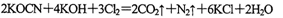
 2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号