将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图: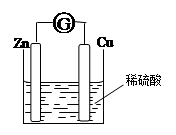
(1) 锌片上发生的电极反应: ;
铜片上发生的电极反应: ;
(2)若该电池中两电极的总质量为60g,工作一段时间后,
取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况
氢气的体积为多少L?
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:
(1) 锌片上发生的电极反应: ;
铜片上发生的电极反应: ;
(2)若该电池中两电极的总质量为60g,工作一段时间后,
取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况
氢气的体积为多少L?