(6分)在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: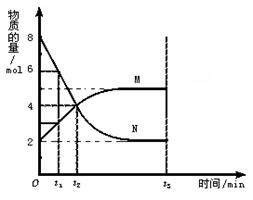
(1)若t1=5S,则前5S用M表示的反应速率为 。
(2)t2时,正反应速率 (填“大于”“等于”或“小于”)逆反应速率。
(3)下列说法正确的是( )
| A.t2时刻该反应达到平衡 |
| B.t3时刻该反应达到平衡 |
| C.反应开始时,生成物的浓度为0 |
| D.该反应的限度是可以改变的 |
(6分)在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
(1)若t1=5S,则前5S用M表示的反应速率为 。
(2)t2时,正反应速率 (填“大于”“等于”或“小于”)逆反应速率。
(3)下列说法正确的是( )
| A.t2时刻该反应达到平衡 |
| B.t3时刻该反应达到平衡 |
| C.反应开始时,生成物的浓度为0 |
| D.该反应的限度是可以改变的 |