由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验,
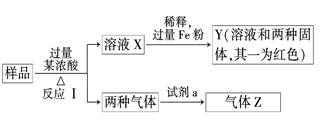
(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成.取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中生成的气体与a反应的化学方程式是_____________________________________
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)______________________________________
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
(5)另取原样品,加入足量稀硫酸充分反应.若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)