恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应 :N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)若反应某时刻t时,n t (N2) =" 13" mol,n t (NH3) =" 6" mol,则a =__________mol;
反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;[
原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =________;
原混合气体中,a∶b =__________;
达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
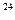 个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是,所含原子数最多的是,质量最大的是,所含电子数最多的是(填序号)
个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是,所含原子数最多的是,质量最大的是,所含电子数最多的是(填序号)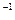 ,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。
,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。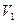 (
(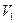 ≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成
≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成 体积的CO2(
体积的CO2( Mg(g)ΔH1="141" kJ·mol-1
Mg(g)ΔH1="141" kJ·mol-1 O2
O2 粤公网安备 44130202000953号
粤公网安备 44130202000953号