化合物A最早发现在酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在铜或银的存在下用空气进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
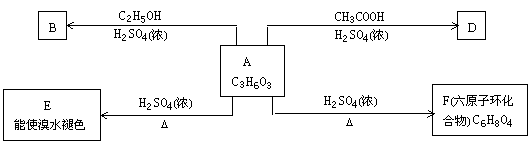
试写出:(每空3分)
(1)化合物的结构简式:A
(2)化学方程式:
A ® E
A ® F
化合物A最早发现在酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在铜或银的存在下用空气进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。

试写出:(每空3分)
(1)化合物的结构简式:A
(2)化学方程式:
A ® E
A ® F