淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质。按要求回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是___________(填一种物质的名称),其净水作用的原理是_________________________ ____。混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要_____________。
(2)硬水的软化指的是_________________________ ____________________________ ___。
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_____________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2____________g, 后加入Na2CO3___________g 。
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极。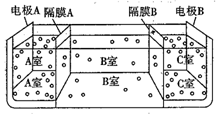
①隔膜A是_________(填“阴”或“阳”)离子交换膜。
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为________________________。