某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
| 实验方法(Ⅰ) |
实验现象(Ⅱ) |
| 1、钠与冷水反应 |
a、溶液变红色 |
| 2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
| 3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
| 5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
| 6、镁带与沸水反应,再向反应后溶液中滴加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
| 7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
| 8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
| 9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| |
1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
||||||
| Ⅰ |
|
|
|
|
|
|
|
|
| Ⅱ |
|
|
|
|
|
|
|
|
(2)实验结论(表示元素具体的强弱顺序):
金属性:____________________ 非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式


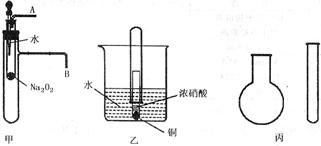
 氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。 检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
 。
。 。
。 粤公网安备 44130202000953号
粤公网安备 44130202000953号