由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。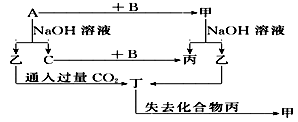
根据图示转化关系回答:
(1)若甲是电解质?写出下列物质的化学式:甲________,乙________,丁________?
写出乙与过量CO2反应的离子方程式_______________________?
(2)若甲是非电解质?写出下列物质的化学式:甲________,乙________,丁________?
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。
根据图示转化关系回答:
(1)若甲是电解质?写出下列物质的化学式:甲________,乙________,丁________?
写出乙与过量CO2反应的离子方程式_______________________?
(2)若甲是非电解质?写出下列物质的化学式:甲________,乙________,丁________?