(10分)按分子结构决定性质的观点可推断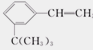 有如下性质:
有如下性质:
(1)苯环部分可发生______反应和__________反应;
(2)—CH=CH2部分可发生_______反应和_______反应;
(3)该有机物滴入溴水后生成产物的结构简式为_____。
(10分)按分子结构决定性质的观点可推断 有如下性质:
有如下性质:
(1)苯环部分可发生______反应和__________反应;
(2)—CH=CH2部分可发生_______反应和_______反应;
(3)该有机物滴入溴水后生成产物的结构简式为_____。