二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1K1
CH3OH(g) ΔH=-90.8 kJ·mol-1K1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1K2
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1K2
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1K3
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1K3
总反应:3H2(g) + 3CO(g) CH3OCH3(g) +CO2 (g)的ΔH= _____ , K= (用包含K1、 K2、 K3的式子表示).一定条件下的等容密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) +CO2 (g)的ΔH= _____ , K= (用包含K1、 K2、 K3的式子表示).一定条件下的等容密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.高温高压 b.加入催化剂 c减少CO2的浓度
d.增加CO的浓度 e.增加H2的浓度 f.充入He
(3)已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v(正) ______ v(逆)(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________,该时间内反应速率v(CH3OH) = __________。
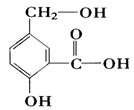
 分子中含氧官能团的名称是;该有机物发生加聚反应后,所得产物的结构简式为。
分子中含氧官能团的名称是;该有机物发生加聚反应后,所得产物的结构简式为。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号