下图是配制溶质质量分数为
的
溶液的实验操作示意图:
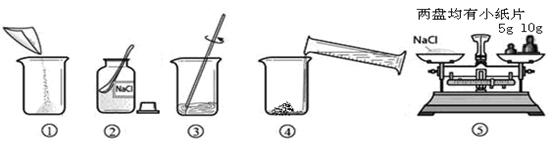
(1)用上图表示的序号表示配制溶液的正确操作顺序
(2)图②中,有一种塑料仪器,其名称是
(3)称量
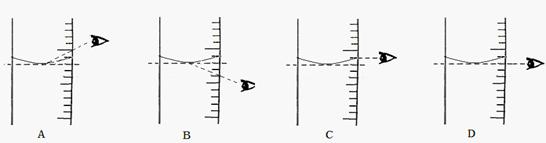
时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为
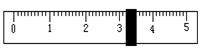
(4)根据计算需要量取水的体积是
(5)称量
质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数
下图是配制溶质质量分数为
的
溶液的实验操作示意图:

(1)用上图表示的序号表示配制溶液的正确操作顺序
(2)图②中,有一种塑料仪器,其名称是
(3)称量
时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为

(4)根据计算需要量取水的体积是

(5)称量
质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数