已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中: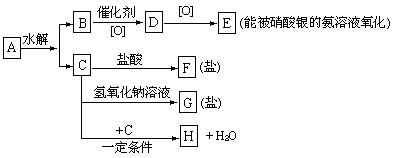
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.
已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中:
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.