(12分)请写出下列有机物的官能团。
CH3CH2CH2COOH , HCOOC2H5 ,
CH3CH2CH2CH2-Cl , CH3CHO ,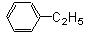 ,
,  ,
,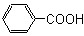 , CH3CH2CH=CHCH3 ,
, CH3CH2CH=CHCH3 ,
(12分)请写出下列有机物的官能团。
CH3CH2CH2COOH , HCOOC2H5 ,
CH3CH2CH2CH2-Cl , CH3CHO , ,
,  ,
,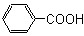 , CH3CH2CH=CHCH3 ,
, CH3CH2CH=CHCH3 ,