50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: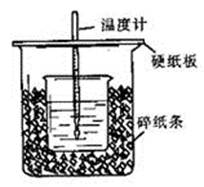
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。
(2)25℃,101kPa时,1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水放出114.6kJ的热量,表示该反应中和热的热化学方程式为________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”、“偏小”、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”、“不相等”),所求中和热_________(填“相等”、“不相等”),简述理由___________________ _________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________________________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会____________ ______。(均填“偏大”、“偏小”、“无影响”)



 粤公网安备 44130202000953号
粤公网安备 44130202000953号