已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①~④均为化合反应。回答下列问题: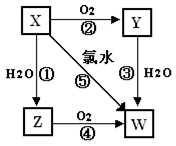
(1)Y的化学式为___________,Z的化学式为____________。X直接排入空气中易造成的环境问题是_______________________。
(2)反应①~⑤中属于可逆反应的是______________。
(3)反应⑤的化学方程式为:_______________________________________________。
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①~④均为化合反应。回答下列问题:
(1)Y的化学式为___________,Z的化学式为____________。X直接排入空气中易造成的环境问题是_______________________。
(2)反应①~⑤中属于可逆反应的是______________。
(3)反应⑤的化学方程式为:_______________________________________________。