蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| |
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
| 开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
| 沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
| |
平行测定数据 |
平均值 |
|||
| 实验编号 |
1 |
2 |
3 |
4 |
|
| 消耗H2O2溶液的体积/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。



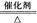 a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
 c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O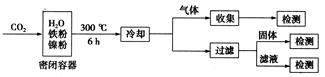

 CO2 HCOOH CH4
CO2 HCOOH CH4 ②由图可知,镍粉是 。(填字母)
②由图可知,镍粉是 。(填字母)

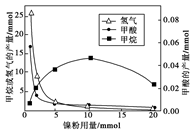
 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号