甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。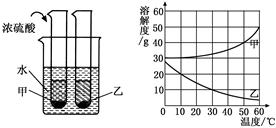
(1)50℃时,甲物质的溶解度是 。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是 。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是 。除了加浓硫酸外,还可以加 物质,也会发生这样的变化。
甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。
(1)50℃时,甲物质的溶解度是 。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是 。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是 。除了加浓硫酸外,还可以加 物质,也会发生这样的变化。