氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)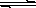 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)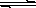 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。