乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):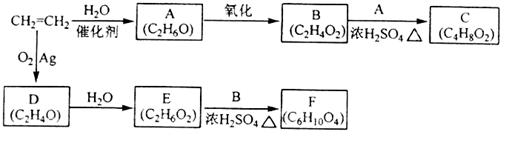
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3)D的结构简式为___________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为___________。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3)D的结构简式为___________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为___________。