图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出: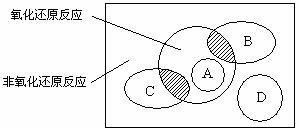
(1)若图中B圈表示化合反应,则C圈表示_______反应(填基本反应类型,下同),A圈表示______反应,D圈表示________反应。
(2)B圈、C圈分别与氧化还原反应重叠的阴影部分用化学方程式各举出一例:
_____________________________;__________________________。
图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)若图中B圈表示化合反应,则C圈表示_______反应(填基本反应类型,下同),A圈表示______反应,D圈表示________反应。
(2)B圈、C圈分别与氧化还原反应重叠的阴影部分用化学方程式各举出一例:
_____________________________;__________________________。