常温下,现有一瓶稀氨水、标准盐酸、pH试纸、必要的酸碱指示剂等药品,要测定 电离度
电离度 的数值,其实验方案可设计如下:
的数值,其实验方案可设计如下:
(1)先测稀氨水的__________,设其数值为a,可通过__________实验(写名称,不用写过程)实现此目的。
(2)再测定其pH,设其数值为b,其操作过程简述如下:__________
(3)用a、b表示该氨水的电离度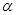 __________。
__________。
常温下,现有一瓶稀氨水、标准盐酸、pH试纸、必要的酸碱指示剂等药品,要测定 电离度
电离度 的数值,其实验方案可设计如下:
的数值,其实验方案可设计如下:
(1)先测稀氨水的__________,设其数值为a,可通过__________实验(写名称,不用写过程)实现此目的。
(2)再测定其pH,设其数值为b,其操作过程简述如下:__________
(3)用a、b表示该氨水的电离度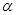 __________。
__________。