阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+ ,有利于人体吸收。
,有利于人体吸收。
⑴
|
在人体中进行的转化时,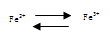 ①中的Fe2+作_____________剂,②中的Fe3+作__________剂;
①中的Fe2+作_____________剂,②中的Fe3+作__________剂;
作__________剂,具有____________性;
⑶ 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转
化成亚铁盐。此反应的离子方程式为_________________________________________。
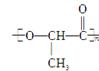 具有良好的生物适应性,能在自然界降解。请回答下列问题:
具有良好的生物适应性,能在自然界降解。请回答下列问题:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号