下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体,F是红棕色气体。根据下图关系推断: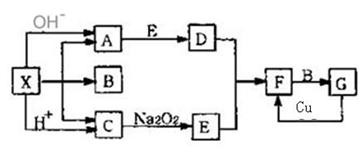
(1)化学式:X ___________。
(2) 写出C—→E的化学反应方程式______________________________________
(3) 请写出F与B反应生成G的化学方程式:____________________,该反应过程中氧化产物和还原产物的物质的量之比为__________________。
下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体,F是红棕色气体。根据下图关系推断:
(1)化学式:X ___________。
(2) 写出C—→E的化学反应方程式______________________________________
(3) 请写出F与B反应生成G的化学方程式:____________________,该反应过程中氧化产物和还原产物的物质的量之比为__________________。