重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶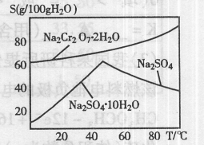
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。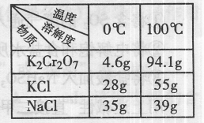
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶 解
解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
 )
)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号