由两种常见金属组成的混合物A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答: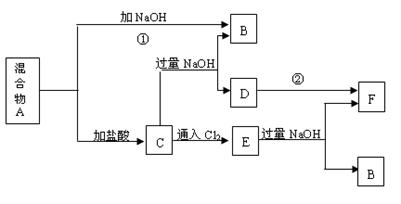
(1)混合物A的成分是 (请填化学式)。
(2)写出反应①的离子方程式为: 。
(3)写出反应②的化学方程式为: 。
由两种常见金属组成的混合物A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
(1)混合物A的成分是 (请填化学式)。
(2)写出反应①的离子方程式为: 。
(3)写出反应②的化学方程式为: 。