硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI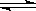 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g)
发生反应Ⅱ,H2物质的量随时间的变化如图所示。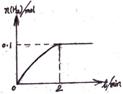
0~2 min内的平均反应速率v(HI)= 。
该温度下,H2(g)+I2(g)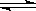 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
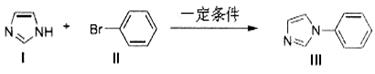
 ,Ⅴ与氢氧化钠溶液醇溶液加热条件下反应的化学方程式为。
,Ⅴ与氢氧化钠溶液醇溶液加热条件下反应的化学方程式为。 与
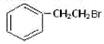
与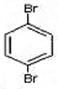 也可以发生类似反应①的反应,参加反应的分子数之比为2:1,则生成的产物的结构简式为。
也可以发生类似反应①的反应,参加反应的分子数之比为2:1,则生成的产物的结构简式为。
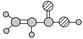

 )和乳酸(
)和乳酸( )为有机物原料合成化工原料肉桂酸(
)为有机物原料合成化工原料肉桂酸( ),涉及的反应方程式为;。
),涉及的反应方程式为;。
 )。
)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号