依据氧化还原反应: 2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题: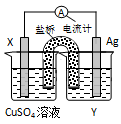
(1)电极X的材料是 ;电解质溶液Y是 。
(2)外电路中的电子是从 电极流向 电极。
(3)银电极上发生的电极反应式为
依据氧化还原反应: 2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)外电路中的电子是从 电极流向 电极。
(3)银电极上发生的电极反应式为