已知水在25℃和99℃时,其电离平衡曲线如右图所示: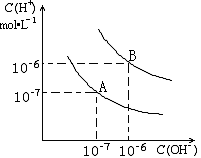
(1)则25 时水的电离平衡曲线应为______(A或B)。
(2)25时,将=9的NaOH溶液与=4的H2SO4溶液混合,若所得混合溶液的=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)99时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是____________________。
已知水在25℃和99℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为______(A或B)。
(2)25时,将=9的NaOH溶液与=4的H2SO4溶液混合,若所得混合溶液的=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)99时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是____________________。