过氧化钠(Na2O2)是一种淡黄色固体,常温下与二氧化碳发生反应的化学方程式为2 Na2O2+2CO2="2" Na2 CO3 + O2 现将沾有Na2O2的棉花放入右图所示的烧杯中,再缓慢向烧杯中倒入适量稀硫酸,使之与杯底的Na2CO3 反应产生 CO2 气体。发现蜡烛火焰熄灭,沾有Na2O2固体的棉花燃烧起来。下列从实验获得的信息中,你认为不正确的是
| A.棉花具有可燃性 |
| B.CO2不支持蜡烛燃烧,但能支持棉花燃烧 |
| C.Na2O2与CO2反应放热,使温度达到棉花的着火点 |
| D.棉花燃烧证明“可燃物、氧气、温度达到着火点”是燃烧必须同时具备的条件 |

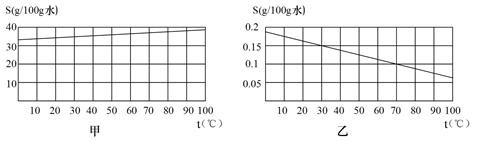
 粤公网安备 44130202000953号
粤公网安备 44130202000953号