(6分)氨气跟氧化铜反应可以制备氮气,化学方程式:2NH3+3CuO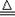 3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.NH4Cl固体与消石灰(Ca(OH)2)共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,N2与H2化合 | D.加热分解NH4Cl固体 |
你认为其中合理的方案有 (填字母);其反应的化学方程式为: ; 。
(6分)氨气跟氧化铜反应可以制备氮气,化学方程式:2NH3+3CuO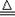 3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.NH4Cl固体与消石灰(Ca(OH)2)共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,N2与H2化合 | D.加热分解NH4Cl固体 |
你认为其中合理的方案有 (填字母);其反应的化学方程式为: ; 。