根据图示回答下列问题: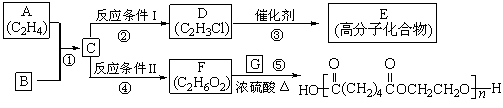
(1)写出A、E、G的结构简式:A____________,E___________,G___________;
(2)反应②的化学方程式(包括反应条件)是:_______________________
反应④化学方程式(包括反应条件)是:__________________________________;
(3)写出①、⑤的反应类型:①________________、⑤______________。
根据图示回答下列问题:
(1)写出A、E、G的结构简式:A____________,E___________,G___________;
(2)反应②的化学方程式(包括反应条件)是:_______________________
反应④化学方程式(包括反应条件)是:__________________________________;
(3)写出①、⑤的反应类型:①________________、⑤______________。