元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的
溶解度(mmol·L-1)如右图。
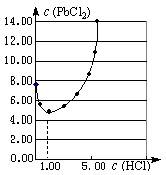
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用。
a.蒸馏水 b.1mol·L-1盐酸
c.5 mol·L-1盐酸 d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大, PbCl2的溶解度减小,其原因是。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式:。
 在一定温度下,HCN在水中存在电离平衡:HCN
在一定温度下,HCN在水中存在电离平衡:HCN H+ + CN-。下列说法错误的
H+ + CN-。下列说法错误的 通入HCl气体,Q>K,平衡逆向移动
通入HCl气体,Q>K,平衡逆向移动 稀释溶液,电离平衡常数减小
稀释溶液,电离平衡常数减小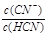 增大
增大 在一定温度下,HCN在水中存在电离平衡:HCN
在一定温度下,HCN在水中存在电离平衡:HCN H+ + CN-。下列说法错误的
H+ + CN-。下列说法错误的 通入HCl气体,Q>K,平衡逆向移动
通入HCl气体,Q>K,平衡逆向移动 稀释溶液,电离平衡常数减小
稀释溶液,电离平衡常数减小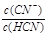 增大
增大