已知A——H有下列转化关系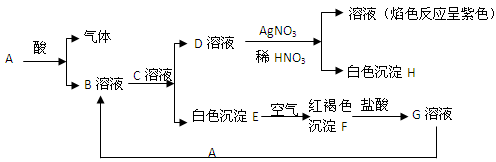
(1)与A反应的酸的名称:
(2)写出E转变成F的化学方程式:
(3)写出D与AgNO3溶液反应的化学方程式:
(4)写出G溶液与A反应的离子方程式
(5)鉴别G溶液常用的试剂是:
已知A——H有下列转化关系
(1)与A反应的酸的名称:
(2)写出E转变成F的化学方程式:
(3)写出D与AgNO3溶液反应的化学方程式:
(4)写出G溶液与A反应的离子方程式
(5)鉴别G溶液常用的试剂是: