目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: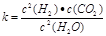 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
容器
|
容积/L
|
温度/℃
|
起始量/mol
|
平衡量/mol[
|
达到平衡所需时间/min
|
C(s)
|
H2O(g)
|
H2(g)
|
甲
|
2
|
T1
|
2
|
4
|
3.2
|
8
|
乙
|
1
|
T2
|
1
|
2
|
1,2
|
3
|
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.="0.8" mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g)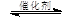 CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2)/ n(CO2)]
|
500 K
|
600 K
|
700 K
|
800 K
|
1.5
|
45%
|
33%
|
20%
|
12%
|
2.0
|
60%
|
43%
|
28%
|
15%
|
3.0
|
83%
|
62%
|
37%
|
22%
|
①该反应的焓变△H0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜g。

