现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。F的水溶液为浅绿色。物质D的焰色为黄色。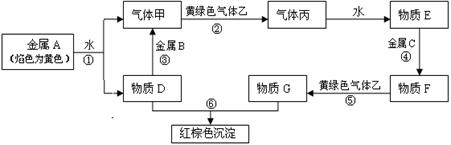
回答下列问题:
(1)写出下列物质的化学式:C G D
(2)写出反应③的离子方程式: 。
(3)描述F溶液中滴加D溶液后的现象 。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。F的水溶液为浅绿色。物质D的焰色为黄色。
回答下列问题:
(1)写出下列物质的化学式:C G D
(2)写出反应③的离子方程式: 。
(3)描述F溶液中滴加D溶液后的现象 。