有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为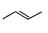 ,某有机物X的键线式为:
,某有机物X的键线式为: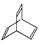
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式。
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z ,Z的二氯代物有 种。
有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为 ,某有机物X的键线式为:
,某有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式。
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z ,Z的二氯代物有 种。