化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 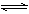 NH3·H2O
NH3·H2O 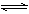 NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 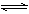 NH3·H2O
NH3·H2O 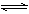 NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。