A是常见的有机物,现有如下反应关系: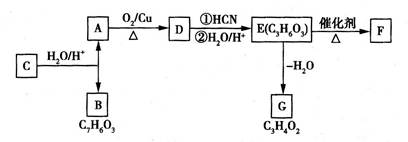
已知:①醛可以发生如下反应: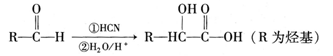
②B与乙酸酐(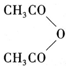 )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林(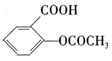 )
)
③F为一种可降解的高分子聚合物
④G在一定条件下可生成(C3H4O2)n
(1)由A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 (写名称)。
(3)G的结构简式是 。
(4)由E生成F的化学方程式是 。
A是常见的有机物,现有如下反应关系:
已知:①醛可以发生如下反应:
②B与乙酸酐( )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林( )
)
③F为一种可降解的高分子聚合物
④G在一定条件下可生成(C3H4O2)n
(1)由A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 (写名称)。
(3)G的结构简式是 。
(4)由E生成F的化学方程式是 。