为了测定某种碱金属的相对原子质量,设计装置如右图。该装置(包括水)的总质量为a g,将质量b g(不足量)碱金属放到水中,立即盖紧瓶塞,反应完全后再称量此装置的总质量为c g,则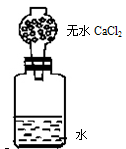
(1)计算该碱金属相对原子质量的数学表达式
(2)无水CaCl2的作用是 ,如果不用无水CaCl2,测出的相对原子质量比实际的相对原子质量 (填写偏大、偏小或相等)。
为了测定某种碱金属的相对原子质量,设计装置如右图。该装置(包括水)的总质量为a g,将质量b g(不足量)碱金属放到水中,立即盖紧瓶塞,反应完全后再称量此装置的总质量为c g,则
(1)计算该碱金属相对原子质量的数学表达式
(2)无水CaCl2的作用是 ,如果不用无水CaCl2,测出的相对原子质量比实际的相对原子质量 (填写偏大、偏小或相等)。