下图中A至F是化合物,G是单质,A的焰色反应为黄色。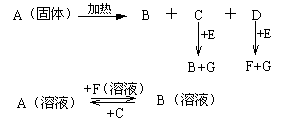
(1)写出B、C的化学式:
B ;C
(2)写出下列反应的离子方程式
①A+F: ②D+E:
(3) 若2molA与1.5molE的混和物在密闭容器中加热后,得到的固体成分为_________
(填名称)
下图中A至F是化合物,G是单质,A的焰色反应为黄色。
(1)写出B、C的化学式:
B ;C
(2)写出下列反应的离子方程式
①A+F: ②D+E:
(3) 若2molA与1.5molE的混和物在密闭容器中加热后,得到的固体成分为_________
(填名称)