某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为2 mL。
⑴请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。 
⑵该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由
⑶某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时): 
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行
(填“是”或“否”)。
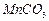 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以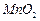 为原料制备少量高纯
为原料制备少量高纯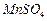 溶液:
溶液: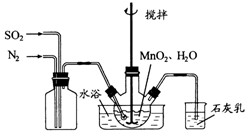
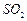 和
和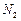 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入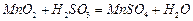 )。
)。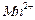 、
、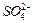 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中
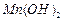 开始沉淀时
开始沉淀时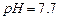 。请补充由(1)制得的
。请补充由(1)制得的 、
、 、
、 、
、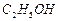 ]。
]。

 光谱法 c.质谱法 d.透射电子显微镜法
光谱法 c.质谱法 d.透射电子显微镜法 (填字母代号)。
(填字母代号)。


 管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母
……;其他可选用的仪器(数量不限)简易表示如下:
管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母
……;其他可选用的仪器(数量不限)简易表示如下:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号