某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: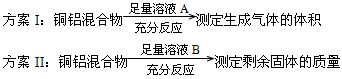
下列有关判断中不正确的是( )
A 溶液A和B均可以是盐酸或NaOH溶液
B 溶液A和B均可以选用稀硝酸
C 若溶液B选用浓硝酸,则测得铜的质量分数偏小
D 实验室方案II更便于实施
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
下列有关判断中不正确的是( )
A 溶液A和B均可以是盐酸或NaOH溶液
B 溶液A和B均可以选用稀硝酸
C 若溶液B选用浓硝酸,则测得铜的质量分数偏小
D 实验室方案II更便于实施