(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙: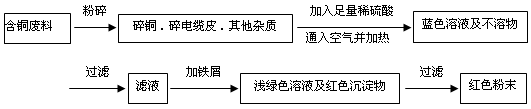
(1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为: ︰ 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号