将镁铝的混合物0.1mol溶于100ml 2mol/L硫酸溶液中,然后再滴加1mol/L的NaOH溶液,请回答:
(1)若在滴加NaOH溶液过程中,沉淀质量随加入NaOH溶液的体积变化如图所示,当V1=160mL时,则金属粉末中n(Mg)= mol, V2= mL,
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积 V(NaOH) = mL
V(NaOH) = mL
(3)图像中A点的意义是 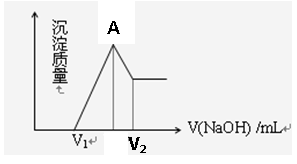
将镁铝的混合物0.1mol溶于100ml 2mol/L硫酸溶液中,然后再滴加1mol/L的NaOH溶液,请回答:
(1)若在滴加NaOH溶液过程中,沉淀质量随加入NaOH溶液的体积变化如图所示,当V1=160mL时,则金属粉末中n(Mg)= mol, V2= mL,
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积 V(NaOH) = mL
V(NaOH) = mL
(3)图像中A点的意义是 