测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃) 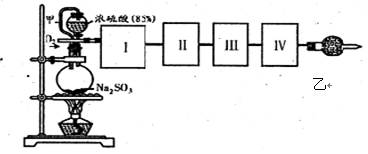
(1)装置中甲管的作用是 ;
乙装置的作用是 。
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是 、 、 、 。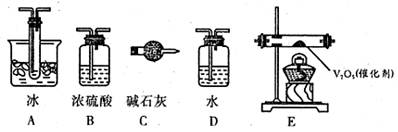
(3)为使SO2有较高的转化率,实验中加热 催化剂与滴加浓硫酸的顺序中,应采取的操作
催化剂与滴加浓硫酸的顺序中,应采取的操作 是 ,若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不
是 ,若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不 变”或“降低”)。
变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为 。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)


 CH3CH2CH2CHO
CH3CH2CH2CHO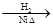 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH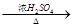 CO↑+H2O(HCOOH还原性强) ②RCH=CH2
CO↑+H2O(HCOOH还原性强) ②RCH=CH2 RCOOH+CO2+H2O
RCOOH+CO2+H2O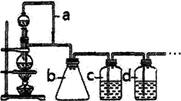

 粤公网安备 44130202000953号
粤公网安备 44130202000953号