工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g) 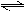 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是 (填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
相关知识点
 粤公网安备 44130202000953号
粤公网安备 44130202000953号