已知X溶液有如图所示转化关系: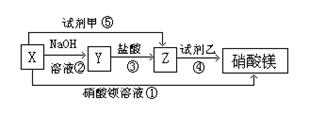
(1)根据上述转化关系,写出下列物质的化学式:X 、Y 、Z 、试剂甲 ,试剂乙 。
(2)写出上述各步反应①~④的离子方程式:
① ;② ;
③ ;④ 。
已知X溶液有如图所示转化关系:
(1)根据上述转化关系,写出下列物质的化学式:X 、Y 、Z 、试剂甲 ,试剂乙 。
(2)写出上述各步反应①~④的离子方程式:
① ;② ;
③ ;④ 。