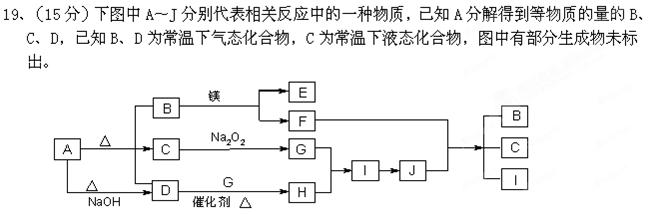
请填写以下空白:
(1)A的化学式 B的电子式 。
(2)写出下列反应的化学方程式:
D+G→ H 。 B+镁 → E + F
B+镁 → E + F  。
。
(3)写出A + NaOH →D的离子方程式 。

请填写以下空白:
(1)A的化学式 B的电子式 。
(2)写出下列反应的化学方程式:
D+G→ H 。 B+镁 → E + F
B+镁 → E + F  。
。
(3)写出A + NaOH →D的离子方程式 。